
Contexte Étude GORTEC TPEx (1) - ppt video online télécharger
Étude GORTEC TPEx (2) Phase II multicentrique Schéma Étude GORTEC TPEx (2) Phase II multicentrique D’après Guigay J et al. J Clin Oncol 2012: abstr actualisé
Contexte Étude GORTEC TPEx (1)
Étude de phase II multicentrique évaluant l’association cétuximab, docétaxel et cisplatine en 1re ligne de traitement des carcinomes épidermoïdes de la tête et du cou métastatiques ou récidivants. Cétuximab en combinaison avec sel de platine et 5-FU : standard en 1re ligne de R/M (schéma EXTREME) [1] Taux de RO : 36 % ; SG médiane : 10,1 mois. Association de cétuximab et de taxane : activité prometteuse (2, 3) Docétaxel + cisplatine (TP) : plus facile à délivrer que cisplatine + 5-FU. Hypothèse : 4 cycles de docétaxel + cisplatine + cétuximab (TPEx) suivis de maintenance par cétuximab toutes les 2 sem. devraient avoir un rapport bénéfice/risque favorable. 1. Vermorken J et al. N Engl J Med 2008;359: ; 2. Kies MS et al. J Clin Oncol 2010;28:8-14 ; 3. Argiris A et al. J Clin Oncol 2010;28: , actualisés.
Schéma. Étude GORTEC TPEx (2) Phase II multicentrique. D’après Guigay J et al. J Clin Oncol 2012: abstr actualisé.
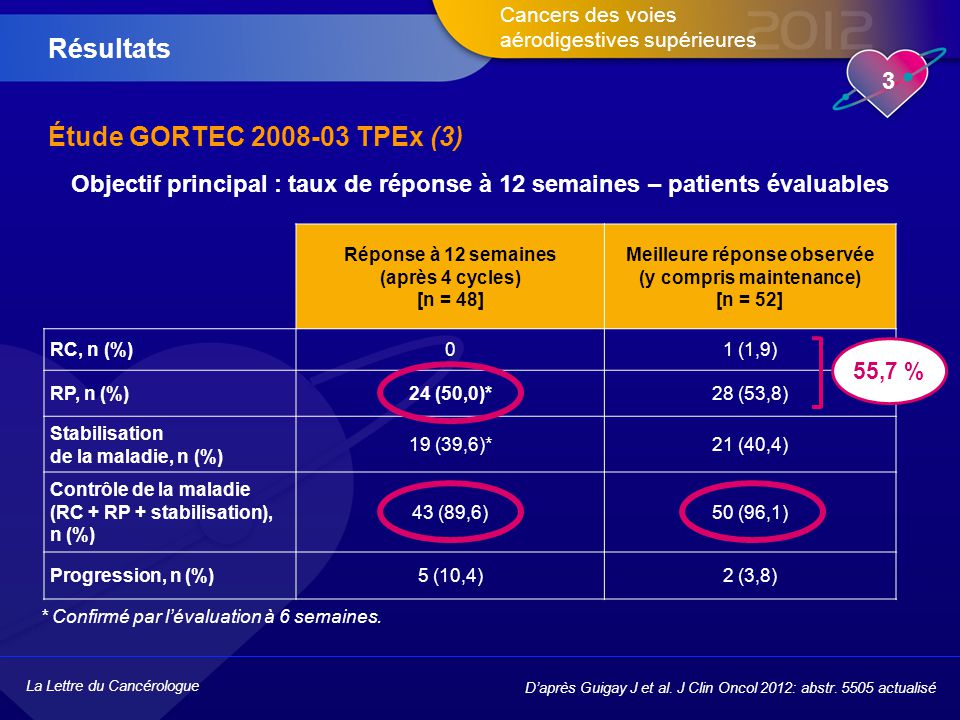
Résultats. Étude GORTEC TPEx (3) Objectif principal : taux de réponse à 12 semaines – patients évaluables. Réponse à 12 semaines. (après 4 cycles) [n = 48] Meilleure réponse observée (y compris maintenance) [n = 52] RC, n (%) 1 (1,9) RP, n (%) 24 (50,0)* 28 (53,8) Stabilisation de la maladie, n (%) 19 (39,6)* 21 (40,4) Contrôle de la maladie (RC + RP + stabilisation), n (%) 43 (89,6) 50 (96,1) Progression, n (%) 5 (10,4) 2 (3,8) 55,7 % * Confirmé par l’évaluation à 6 semaines. D’après Guigay J et al. J Clin Oncol 2012: abstr actualisé.
Taux de réponse : population totale en ITT. Réponse à 12 semaines. (après 4 cycles) [n = 54] Meilleure réponse observée (y compris maintenance) Meilleure réponse globale (y compris maintenance) RC, n (%) 1 (1,9) 1 (1,9)* RP, n (%) 24 (44,4)* 28 (51,9) Stabilisation de la maladie, n (%) 19 (35,2)* 21 (38,9) 18 (33,3) Contrôle de la maladie (RC + RP + stabilisation), n (%) 43 (79,6) 50 (92,6) Progression, n (%) 5 (9,3) 2 (3,7) Inévaluable pour la réponse, n (%) 6 (11,1) 53,8 % 46,3 % * Confirmé par l’évaluation à 6 semaines. D’après Guigay J et al. J Clin Oncol 2012: abstr actualisé.
Résultats. Étude GORTEC TPEx (5) Survie globale : population en ITT. SG à 1 an : 59,3 % SG médiane : 14 mois. IC95 : 11,3-17,3. Population globale. Censurés. 14. D’après Guigay J et al. J Clin Oncol 2012: abstr actualisé.
Résultats. Étude GORTEC TPEx (6) Survie globale : patients qui ont pu débuter la maintenance. (n = 42, soit 77,8 % de la population en ITT) SG à 1 an : 71,4 % Survie médiane : 16,8 mois. IC95 : 13,8-27,3. Population globale. Censurés. 16,8. D’après Guigay J et al. J Clin Oncol 2012: abstr actualisé.
Tolérance satisfaisante avec le G-CSF. La dose intensité a été maintenue. Maintenance toutes les 2 semaines bien tolérée sans perte d’efficacité. Taux de réponse élevé : 50 % après 4 cycles. Survie médiane > 1 an et longues survies chez les patients répondeurs. ➜ TPEx : alternative pour les patients avec bon PS. ➜ Phase III versus EXTREME planifiée. D’après Guigay J et al. J Clin Oncol 2012: abstr actualisé.
CMT : 5 à 8 % des tumeurs thyroïdiennes. Progression pas de standard. Étude positive avec le vandétanib AMM. EXAM : étude internationale du cabozantinib ciblant RET, VEGF, cMET. Phase III. CMT en progression. RET : 48 % Mesurable : 96 % Prétraité par ITK : 21 % Objectif principal : SSP. (n = 330) Cabozantinib 140 mg/j. R. Placebo. D’après Schoffski P et al. J Clin Oncol 2012: abstr actualisé.
Résultats. Étude EXAM : apport du cabozantinib (XL184) dans les cancers médullaires de la thyroïde (2) Survie sans progression. Cabozantinib. Placebo. SSP à 1 an (%) 47,3. 7,2. HR = 0,28 ; lC95 : 0,19-0,40 ; p < 0, ,0. 11,2. 20 % d’arrêts pour toxicité. D’après Schoffski P et al. J Clin Oncol 2012: abstr actualisé.
Apport majeur des thérapies moléculaires ciblées dans les CMT. Les résultats d’efficacité sont très satisfaisants avec un taux de RO de 28 % et une SSP majorée de 7,2 mois (pas assez de recul pour la SG) La toxicité a été fréquente avec des diarrhées, des syndromes mains-pieds et des épisodes d’hypocalcémie. Après le vandétanib, le cabozantinib est désormais dans l’arsenal thérapeutique de ces tumeurs difficiles à traiter. D’après Schoffski P et al. J Clin Oncol 2012: abstr actualisé.
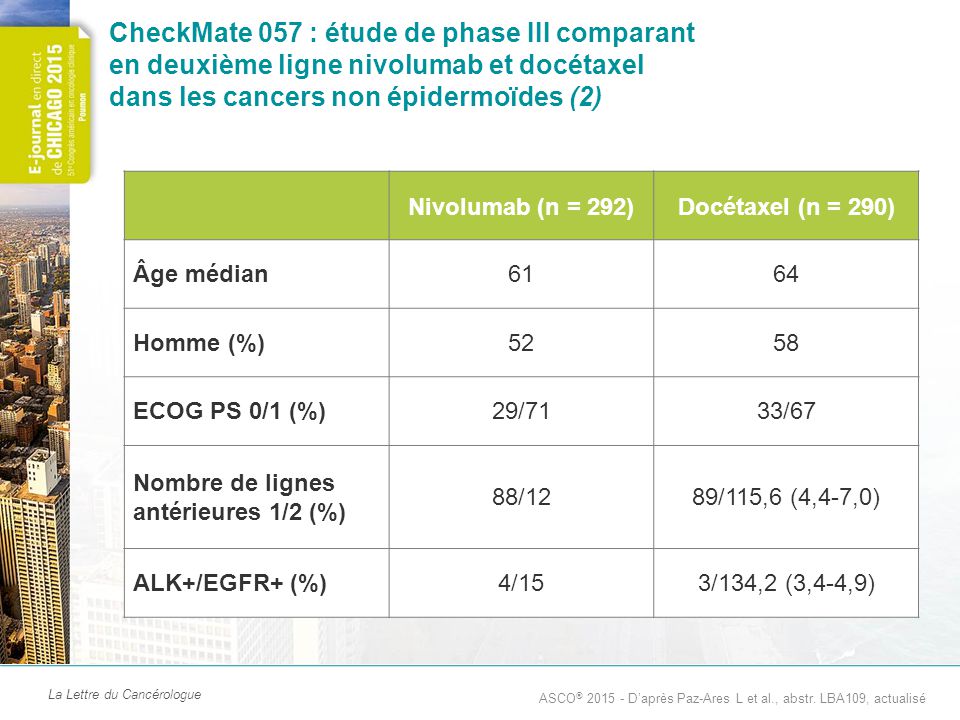
CheckMate 057 : étude de phase III comparant en deuxième ligne

KEYNOTE-012 : Cohorte cancer urothélial - ppt video online télécharger

Rapport Tfe STDJN Ok, PDF, Génie géotechnique

e-DocPro, la ged collaborative by EUKLES Solutions - Issuu

Cetuximab, docetaxel, and cisplatin versus platinum, fluorouracil

Gestion de Contenu Vidéo pour l'Éducation - Panopto

11 - PERT Corrigé, PDF, Développement de produit
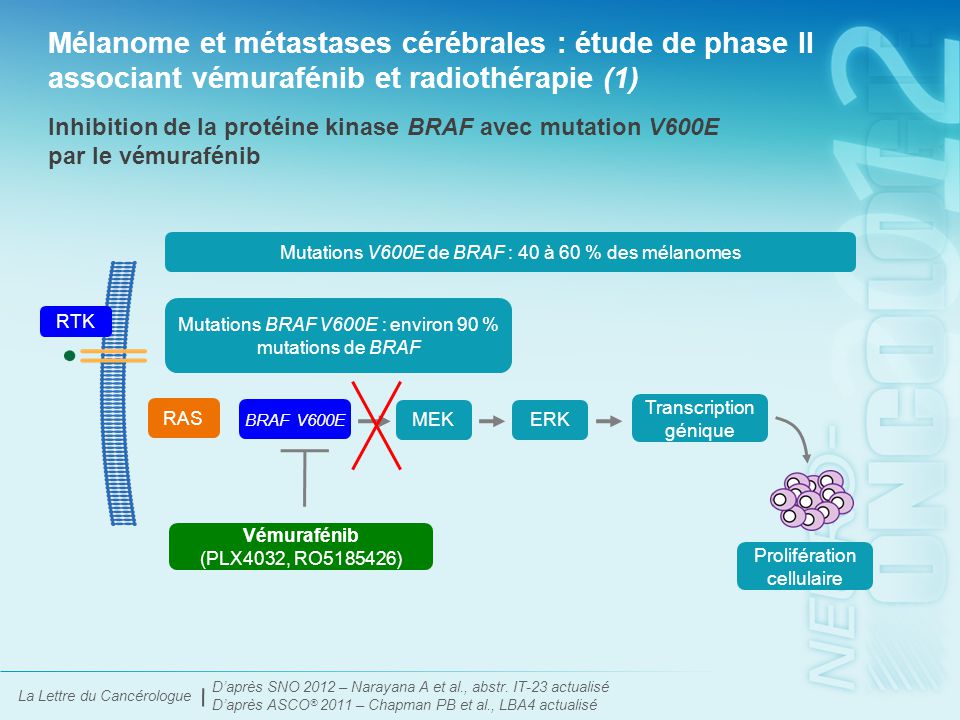
Mélanome et métastases cérébrales : étude de phase II associant

061011 Introduction à la Gestion Electronique des Documents

Cetuximab, docetaxel, and cisplatin (TPEx) as first-line treatment
Contexte Étude GORTEC TPEx (1) - ppt video online télécharger

HQCA 2021 Conference PPT Video







